 |
Тема урока: «Электролитическая диссоциация»Цель урока: обобщить и расширить знания учащихся об электролитической диссоциации. Задачи урока: 1. Образовательные: Продолжать формирование понятий о растворении как физико-химическом процессе, об ионах и механизме электролитической диссоциации. 2. Развивающие: а) учебно-познавательные: развитие навыков самостоятельной познавательной деятельности; умения ставить познавательную задачу, умения добывать знания, выделять главное, обобщать, делать выводы; б) коммуникативные: развитие умения ответить на поставленный вопрос; в) информационные: развитие умения сравнивать, выделять существенные признаки, извлекать необходимую информацию из проводимого эксперимента; оформлять и представлять результаты своей работы. 3. Воспитательные: воспитывать сознательное отношение к учебному труду, чувство ответственности, развивать интерес к знаниям. 4. Здоровьесберегающие: закрепить навыки безопасного обращения с реактивами и приборами. Планируемые результаты обучения: В результате изучения данного материала учащиеся должны: Знать: а) определение понятий – электролиты; неэлектролиты; электролитическая диссоциация; основания, кислоты, соли в свете теории электролитической диссоциации (ТЭД) в ходе обобщения знаний; б) электрическую проводимость различных веществ; в) значение электролитической диссоциации в повседневной жизни человека. Уметь: а) составлять уравнения электролитической диссоциации кислот, оснований, солей; б) пользоваться таблицей растворимости; в) извлекать необходимую информацию из проводимого эксперимента и делать соответствующие выводы. Тип урока: урок обобщающего типа Этапы урока 1. Организационный момент, постановка цели урока 2. Проверка домашнего задания 3. Лабораторный опыт 4. Закрепление знаний 5. Домашнее задание, подведение итогов урока Подготовка к уроку Оборудование: 1) Прибор для демонстрации опытов с электрическим током 2) 6 химических стаканов, 2 стеклянные палочки 3) Компьютер, проектор, экран мобильный Реактивы: 1) Кристаллическая поваренная соль и сахар 2) Раствор гидроксида натрия 3) Раствор соляной кислоты 4) Дистиллированная вода 1 этап. Организационный. Здравствуйте, ребята. Сегодня у нас с вами урок-обобщение по теме «Электролитическая диссоциация» (слайд № 1). На этом уроке мы проверим домашнее задание, вспомним основные понятия этой темы, проведём опыты по испытанию веществ на электрическую проводимость и закрепим полученные знания, выполнив задания у доски (слайды № 2, 3). 2 этап. Проверка домашнего задания (слайды № 4, 5) Вопросы ученикам: 1. Дайте определения следующим терминам с точки зрения ТЭД: • основания – это • кислоты – это • соли – это 2. Что называется электролитической диссоциацией? 3. Какие вещества называются электролитами? 4. Какие вещества называются неэлектролитами? 5. А что такое электрический ток? 6. Какие вещества помимо электролитов проводят электрический ток? (металлы). Итак, мы выяснили, что и металлы, и электролиты проводят эл.ток. Почему? Какие заряженные частицы есть у металлов, а какие у электролитов? Таким образом, мы с вами вспомнили, что металлы имеют заряженные частицы – электроны, а электролиты – ионы. А наличие свободных заряженных частиц – необходимое условие для прохождения эл.тока. 3 этап. Лабораторный опыт. Ребята, давайте на опыте проверим электрическую проводимость некоторых веществ. Это мы сделаем с помощью прибора, который вы видите передо мной. Параллельно с проведением опыта мы будем заполнять таблицу по электрической проводимости некоторых веществ (слайд № 6). Перечертите её в тетрадь (незаполненная на слайде). 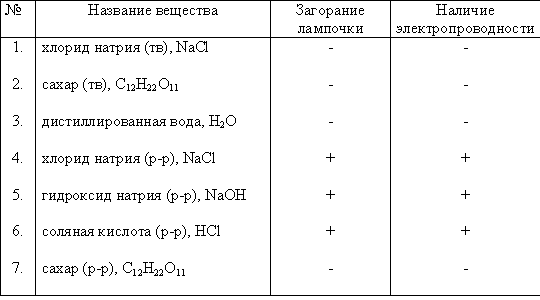 2) Возьмем сахар (органическое вещество). Лампочка тоже не горит. Твердые вещества не проводят электрический ток. 3) Проверим, является ли электролитом дистиллированная вода. Лампочка не горит. Ионов в дистиллированной воде совсем немного, поэтому электропроводность воды низкая. Дистиллированная вода – очень слабый электролит. 4) Электропроводны ли растворы солей, щелочей, кислот? Раствор гидроксида натрия электропроводен: лампочка загорается. Лампочка горит и при испытании раствора поваренной соли. Электропроводен также раствор соляной кислоты (HCl). Все испытанные растворы оказались электролитами. Какие выводы мы можем сделать, проведя данные опыты? Какие вещества у нас проводили эл. ток, а какие нет? Выводы (слайд № 7): Твёрдые вещества не проводят эл.ток. Растворы солей, щёлочей, кислот – электролиты, проводят эл.ток. Растворы, в которых нет заряженных частиц – неэлектролиты, не проводят эл.ток. 4 этап. Закрепление знаний (слайд № 8) 1. Среди перечисленных формул выберите: электролиты и неэлектролиты. Формулы: CO2; H2SO4; CuCl2; Fe(OH)3; Al2(SO4)3; H2SiO3; NaOH; CuO; HCl; BaSO4; K2CO3 (слайд № 9) 2. Напишите уравнения электролитической диссоциации следующих кислот: а) бромоводородной кислоты б) сернистой кислоты в) фосфорной кислоты г) сероводородной кислоты д) серной кислоты е) азотной кислоты (слайд № 10) 3. Напишите уравнения электролитической диссоциации следующих солей: а) ZnCl2 б) Al(NO3)3 в) K2SO4 г) Na2CO3 д) K3PO4 е) FeCl3 (слайд № 11) 4. Напишите уравнения диссоциации электролитов, которые распадаются на следующие ионы: а) Na+ и OH- б) Ca2+ и OH- в) Ba2+ и OH- г) K+ и OH- Слайд № 12. Ребята, подумайте, а где вы в повседневной жизни уже сталкивались с явлением электролитической диссоциации и где оно применяется? Слайд № 13. Аккумуляторы заливают растворами электролитов: кислот и щелочей, которые проводят электрический ток. Знание этого материала может пригодиться всем, кто имеет дело с техникой. 5 этап. Домашнее задание, подведение итогов урока (слайд № 14) Итак, мы с вами обобщили основные сведение по электролитической диссоциации. Домашнее задание § 36, стр. 203 упр 5. Выставление оценок за работу на уроке. |
|
|